纯碱(苏打)是如何生产出来的
纯碱,又名苏打,学名为碳酸钠,化学式为Na2CO3,是一种非常重要的化工原料,广泛应用于制造玻璃、冶炼金属、印染、洗涤等方面。那么纯碱是怎么制备出来的?想知道纯碱的制备工艺吗?

制备纯碱最为著名的技术有两种。一种是氨碱法制纯碱,由比利时人索尔维研制,又名索氏制碱法,另一种是联合制碱法,由我国的侯德榜先生研制,又名侯氏制碱法。
这两项技术原理相同,总反应方程式为:

从原理反应中,可以看到,反应原料有四种,分别是NaCl、NH3、H2O 和 CO2 。但两项技术的原料获取方式不同。
氨碱法
原料盐(NaCl)和水,可以直接获取。
原料CO2 来源于是煅烧石灰石。
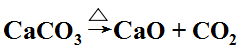
产生的CaO可以用来回收NH4+ (NH4Cl),实现NH3的循环使用。
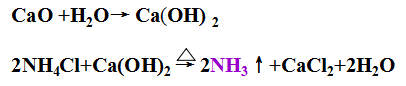
原料氨可以循环利用。 
优点:
1、原料石灰石、盐(NaCl)、水,价格便宜,易于获取。
2、另一原料氨,可以循环利用,损伤较少。
3、能够大规模连续生产,易于机械化,自动化,可得到较高质量的纯碱。
缺点:
1、原料利用率低,造成大量含有Cl-的废液排出,严重污染环境。
2、蒸馏以回收氨,需设置蒸氨塔,消耗大量的蒸汽和石灰,从而造成流程长,设备庞大和能量上的浪费。
工艺主要过程
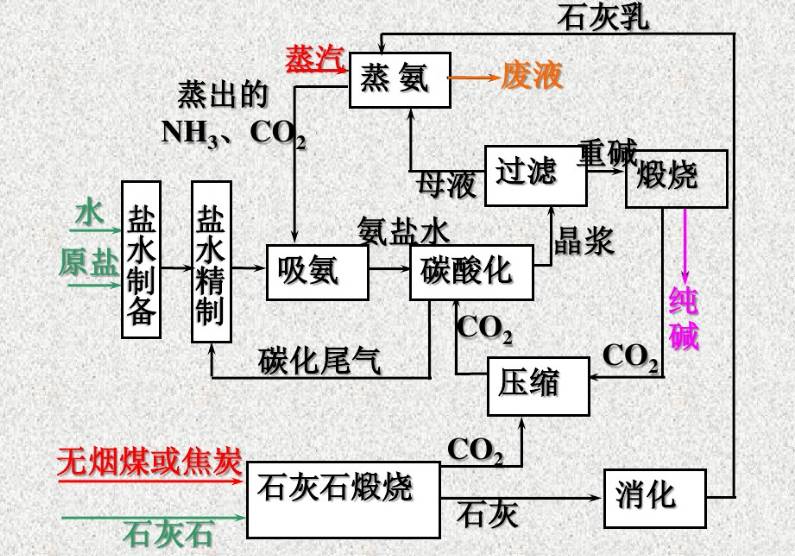
1、CO2 气体和石灰乳的制备。煅烧石灰石制得石灰和二氧化碳,将石灰入水得石灰乳。
2、盐水的制备、精制及氨化,制氨盐水。
3、氨盐水的碳酸化制重碱。来自石灰石煅烧及重碱煅烧的CO2,经压缩、冷却送至碳化塔。
4、重碱的过滤及洗涤(即碳化所得晶浆的液固分离)。
5、重碱煅烧制得纯碱成品及CO2。
6、母液中氨的蒸馏回收。
下面为大家详细介绍。
1,石灰石煅烧与制备石灰乳
石灰窑图解
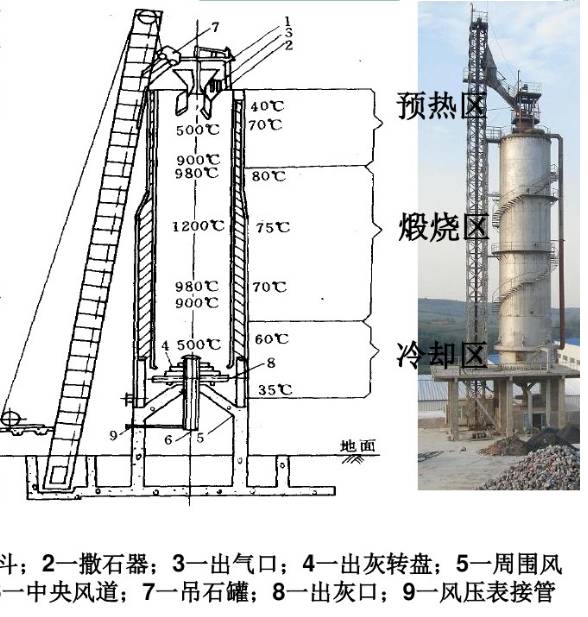
CO2是由煅烧石灰石得到的,反应简单但工业过程并不容易。
生产上为了保证反应速度,温度比计算的略高,窑内温度范围940-1200°C。温度太高,可能结疤影响生产正常进行,或生成“过烧石灰”也不利。
煅烧石灰石得到的CaO先与水反应生成氢氧化钙。实际生产中氢氧化钙是过饱和的,是溶液与未溶解固体的混合物,称为石灰乳。要求石灰乳较稠为好,这样对蒸氨过程有利。但太稠了粘度大,易堵塞管道。其在水中溶解度很低,且随温度升高而降低。
2,饱和食盐水制备和精制

目的: 是将粗盐中所含杂质如Ca盐和Mg盐等除去,因为在吸收氨和碳酸化过程中,可能生成氢氧化镁和碳酸钙沉淀,使管道堵塞或影响产品质量。
方法: 先加入石灰乳使镁离子变成钙离子:
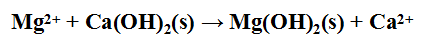
除钙可用下列两法之一:
A(石灰塔气法 )和B(石灰纯碱法)
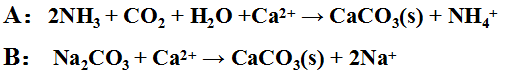
3,盐水吸氨制氨盐水
吸氨过程的主要反应为:
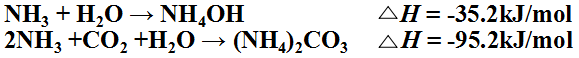
反应放热较多,每千克氨吸收成氨盐水可放热4280kJ。如不及时移走,可使系统温度升高到90℃以上 。温度升高,氨分压增加,对吸收过程是不利的。所以要用多个塔外水冷器冷却。使塔中部温度为60 ℃ ,底部为30 ℃。 副反应有与钙镁离子反应生成沉淀的反应。
吸氨的主要设备是吸氨塔。氨从中部引入,引入处反应剧烈,温升大,所以部分吸氨液循环冷却后继续。上部各段都有溶液冷却循环以保证塔内温度。澄清桶的目的是除去少量钙镁盐沉淀,达到杂质含量少于0.1kg/m-3的标准。操作压力略低于大气压,减少氨损失和循环氨引入。
4,氨盐水的碳酸化
碳酸化过程分为三步:氨盐水先与CO2反应生成氨基甲酸铵,然后再水解生成碳酸氢铵,再与钠离子反应生成碳酸氢钠。
氨盐水碳酸化反应是放热反应,放热量不大,但是要注意冷却才能保证反应正常进行。
氨盐水进塔温度约30~50 ℃,塔中部温度升到60 ℃左右,中部不冷却,但下部要冷却,控制塔底温度在30 ℃以下,保证结晶析出。
温度条件中注意碳化塔中部温度高些。其原因是一方面反应本身有一些热量放出,另一方面主要是考虑结晶初期温度高一点对晶粒长大有利,可形成较大晶体以利过滤。同时冷却速度不宜过快,过快可能形成结晶浆,难于过滤分离。
生产中要注意清洗堵塞的结晶及杂质沉淀。往往一塔生产,另一塔清洗。用新鲜氨盐水和CO2使结晶生成碳酸盐溶解除去。
5,氨的回收
氨碱法生产纯碱时,氨是循环利用的。因此要将母液中的氨盐分解以回收氨。此过程称为蒸氨过程。
实际操作过程中还应注意加热段与石灰乳蒸馏段连接处。因加热后液体基本无游离氨,平衡氨分压接近零。而下部来的气体氨含量高,所以有部分氨反而要溶于液体中,加热段并不能完全将游离氨除净。
6,重质纯碱的制造
过滤:分离晶浆中悬浮的固相NaHCO3 (45~50%),在过滤 的同时进行洗涤,把重碱中残留的母液洗去,并进行脱水,使重碱含水量降低。
所得到的粗重碱的组分一般为下图所示:

煅烧后,首先驱出游离水分,然后进行碳酸氢铵和碳酸氢钠的分解,获得产品NaCO3。
重碱煅烧反应方程式: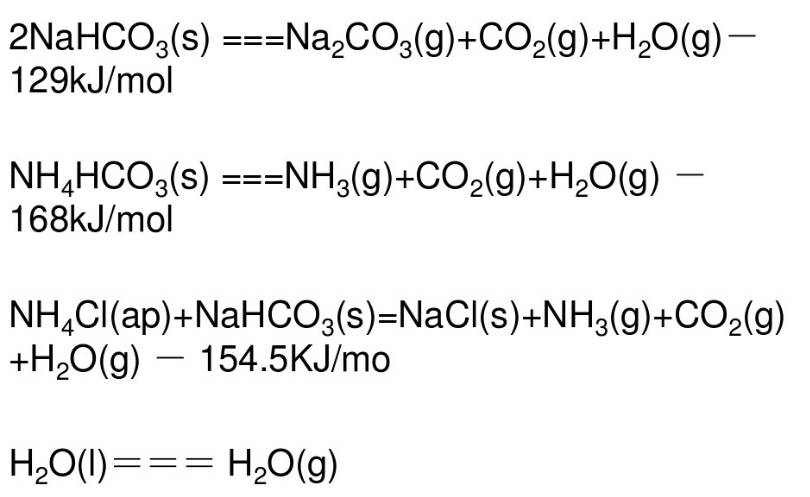
重碱煅烧的工艺流程

| 上一条信息:工业锅炉常识,看典型... | 下一条信息:十几个省市对化工企业... | 返回列表 |